ההבדל בין טיטרציה של חומצה-בסיס לבין טיטרציה של חנקן | חומצה בסיס טיטרציה לעומת טיטרציה חמצון
ההבדל העיקרי - חומצה Base טיטרציה לעומת טיטרציה Redox
באופן כללי, titrations משמשים כדי לקבוע את הריכוז של פתרון לא ידוע (אנליט). הנפוץ ביותר שתי שיטות titrimetric הם חומצה בסיס titrations ו titrations טיפה. ההבדל בין הבדלים בחומצה לבין טיטרציות לחמצן הוא טבע התגובה המתרחשת בין הטיטר לבין האנליטי בטיטרציה. ב טיטרציות בסיס חומצה, התגובה נייטרלי מתרחש ו טיטרציות חנק, תגובה החזרה מתרחשת (תגובה חמצון תגובה הפחתת). השימוש במדדים הוא השיטה הנפוצה ביותר לקביעת נקודת הסיום של התגובה. -> ->
מהו טיטרציה חומצית בסיס?ב titrations חומצה בסיס, חומצה (טיטרציות חומציות) או בסיס (טיטרציות בסיסיות) משמש טיטרנט. דוגמאות של חומצות המשמשות טיטרציות חומצי הם H
2 אז 4 , HCl, או HNO 3. טיטרנטים בסיסיים משומשים הם NaOH, K 2 CO 3 או 2 CO 3. חומצה בסיס titrations ניתן לסווג כדלקמן בהתאם לחומצה של החומצה ואת הבסיס. -> ->
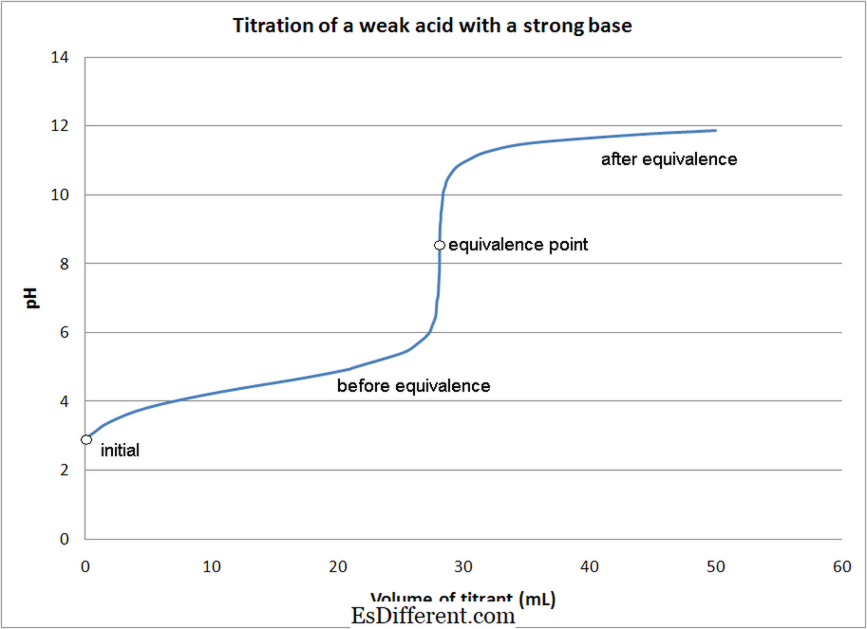
חומצה חזקה - טיטרציות בסיס חזקות- חומציות חזקות - טיטרציות בסיס חלשות
- חומצה חלשה - טיטרציות בסיס חזקות
- חומצה חלשה - טיטרציות בסיס חלשות
- ברוב החומצה - טיטרציות בסיס, אינדיקטורים משמשים כדי לקבוע את נקודת הסיום של התגובה. אינדיקטורים שונים משמשים בהתאם לסוג טיטרציה כאמור.
-> ->
טיטרציה לחזרה כוללת תגובה לחזרה. לתגובת החמצון יש שתי תגובות; תגובה חמצון תגובה ירידה. גם תהליכי החמצון וההפחתה מתרחשים בעת ובעונה אחת ומאפשרים לנו לקבוע את השלמת התגובה. זה ידוע גם כנקודת הסיום של טיטרציה. זה יכול להיקבע במספר דרכים; באמצעות אלקטרודות מחוון, מחווני מחוון (המחוון מייצר צבע שונה במצב הפחתת חמצון), ואינדיקטורים שאינם מחזירים (מחוון מייצר צבע כאשר כמות עודפת של טיטרנט נוסף).
מה ההבדל בין חומצה בסיס טיטרציה ו טיטרציה החמצה?

הטבע של התגובה:
חומצה בסיס טיטרציה:
טיטרציה חומצית בסיס כרוך בתגובה נייטרלי בין האנליטי (הפתרון עם ריכוז לא ידוע) לבין טיטרנט חומצי או בסיסי. Redox טיטרציה:
תגובה לחזרה כוללת תגובה של חמצון והקטנה בין האנליטי לבין הטיטרנט. אין כלל כזה שהרכיב מתחמצן ומי מפחית. או אנליטי או titrant oxidizes, ואת הרכיב הנותר מפחית בהתאם. קביעת נקודת הסיום:
חומצה בסיס טיטרציה:
באופן כללי, מחוון pH, מד pH או מד מוליכות משמש כדי לקבוע את נקודת הסיום של טיטרציה חומצית בסיס. Redox טיטרציה:
השיטות הנפוצות ביותר לקביעת נקודת הסיום של תגובה לחזרה הן באמצעות פוטנציומטרים או מחוון חיזוי. אבל, בתדירות הגבוהה ביותר או אנליט או את העריץ מייצר צבע בנקודת הקצה. לכן, אינדיקטורים נוספים אינם נדרשים במקרים אלה. דוגמאות:
Acid-Base טיטרציה:
- diff מאמר לפני הטבלה ->
סוג| תגובה (מחוון) | חומצה חזקה - טיטרציה בסיסית חזקה |
| HCl + NaOHàNaCl + H | 2 O (Phenolphthalein / Methyl כתום> כתום HCL + NH |
| 3 | NH 3 Cl (כתום מתיל) חומצה חלשה - טיטרציה בסיסית חזקה |
| 3 | COOH + NaOHà CH קונה + H 2 O (Phenolphthalein) חלש חלש בסיס טיטרציה CH 3 |
| COOH + NH | 3 aCH 3 COO - + NH 4 + (ללא מחוונים מתאימים) צמצם את הגדילה: 2 קנו 4 |
+ 5 H
2 C 2 O 4 + 6 HCl → 2> MnCl 2 + 2KCl + 10 CO 2 + 8 H 2 O (+ 7) (+3) (+2) 4) בתגובה לעיל, permanganate מצטמצם בעוד חומצה אוקסלית הוא מחומצן. כאשר התגובה משלים, את צבע סגול של שינויים permanganate לתוך חסר צבע.
5
+ 5FeCl
2 8HCl → 5FeCl 3 + MnCl 2 + KCl + 4H 2 O (+ 7) (+2) (+3) (+2) תמונה באדיבות: 1. טיטרציה של חומצה חלשה עם בסיס חזק על ידי Quantumkinetics (עבודה משל) [CC BY 3. 0], באמצעות ויקיפדיה
2. "וינקלר טיטרציה טיטרציה מראש" מאת ווילווד [CC BY-SA 3. 0] via Commons




