ההבדל בין הידרוקסיל להידרוקסיד | הידרוקסיל לעומת הידרוקסיד
ההבדל העיקרי - הידרוקסיל לעומת הידרוקסיד
שני המונחים hydroxyl ו hydroxide נשמע דומה מאוד שכן שניהם יש שני אטומים דומים, חמצן (O = 16) ו מימן (H = 1).
הידרוקסיד הוא יון שלילי עם מטען יחיד hydroxyl לא נמצא בצורתו החופשית, הוא חלק של מולקולה אחרת או יון. הידרוקסיד יונים יותר תגובתי מאשר קבוצת hydroxyl במולקולה. זהו ההבדל העיקרי בין הידרוקסיל להידרוקסיד. -> ->
מהו הידרוקסיל?הידרוקסיל הוא תרכובת נייטרלי וזה התרכובת ניטרלית חשמלית המתאים של יון hydroxide. הצורה החופשית של הידרוקסיל (HO) היא רדיקלית וכאשר היא מלוכדת קוולנטית למולקולות אחרות היא מסומנת כקבוצת הידרוקסיל (-OH). קבוצות hydroxyl יכול לפעול כמו נוקלאופילים הרדיקלים hydroxyl משמש זרז בכימיה אורגנית. קבוצות hydroxyl הם לא מאוד תגובתי כמו נוקלאופילים אחרים. עם זאת, הם המנחים בהקמת כוחות intramolecular חזקה בשם "קשרי מימן".
-> ->

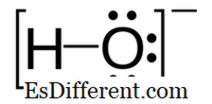
הידרוקסיד הוא אניון דיאטומי המכיל אטום חמצן ואטום מימן. הקשר בין אטום חמצן ומימן הוא קוולנטי והנוסחה הכימית שלו היא OH
- . יינון עצמי של מים מייצר יונים hydroxyl ולכן יוני hydroxyl הם חלק טבעי במים. יונים הידרוקסיד משמשים כבסיס, ליגנד, נוקלאופיל וזרז בתגובות כימיות. בנוסף, יונים מימן לייצר מלחים עם קטיוני מתכת ורובם לנתק פתרונות מימיים, משחרר יוני hydroxide solvated. חומרים כימיים אנאורגניים רבים מכילים את המונח "הידרוקסיד" בשמם, אך הם אינם יוניים והם תרכובות קוולנטיות המכילות קבוצות הידרוקסיל. -> ->

מבנה:
הידרוקסיל:
הידרוקסיל הוא תרכובת ניטרלית חשמלית אשר ניתן למצוא שתי דרכים, כמו הרדיקלי טופס קשורה קוולנטית. הידרוקסיל הרדיקלי כאשר הוא מלוכדות קוולנטית מולקולה

הידרוקסיד:
הידרוקסיד הוא יון טעונה שלילית ואת המטען השלילי הוא על אטום החמצן. מאפיינים:
קבוצות הידרוקסיל נמצאים תרכובות אורגניות רבות; אלכוהולים, חומצות קרבוקסיליות וקבוצות הידרוקסיל המכילות סוכר. תרכובות המכילות קבוצות hydroxyl כגון מים, אלכוהול, וחומצות carboxylic יכול להיות deprotonated בקלות.בנוסף, אלה קבוצות hydroxyls עוסקים היווצרות של קשרי מימן. קשרי מימן לעזור מולקולות להיצמד יחד וזה מוביל החזקה של נקודות רותחים יותר ההיתוך. באופן כללי, תרכובות אורגניות הם מסיסים במים; אלה מולקולות להיות מעט מים מסיסים כאשר הם מכילים שתי קבוצות hydroxyl או יותר. הידרוקסיד:
רוב הכימיקלים המכילים hydroxide נחשבים מאוד קורוזיביים, וחלקם מזיקים מאוד. כאשר כימיקלים אלה מומסים במים, יון hydroxide פועל כבסיס חזק להפליא. מאז יון hydroxide נושאת מטען שלילי, הוא מלוכדות לעתים קרובות יונים טעונה חיובי. כמה תרכובות יוניות המכילות קבוצות הידרוקסיד במולקולה שלהן מתמוססות היטב במים; בסיסיים, כמו בסיסים של הידרוקסיד נתרן (NaOH) ואשלגן הידרוקסיד (KOH). עם זאת, כמה הידרוקסיד אחרים המכילים תרכובות יוניות הם מעט מסיסים במים; הדוגמאות הן הידרוקסיד הנחושת (II) [Cu (OH)
2 - צבע כחול בהיר] וברזל (II) הידרוקסיד [Fe (OH) 2 - חום]. תגובתיות:
Hydroxyl
: קבוצות הידרוקסיל הן פחות תגובתי בהשוואה לקבוצה hydroxide. אבל, קבוצות hydroxyl בקלות ליצור קשרים מימן ולתרום להפוך מולקולות מסיסות יותר במים. עם זאת, רדיקלים הידרוקסיל הם תגובתי מאוד שימושי מאוד תגובות כימיות אורגניות.
הידרוקסיד:
הידרוקסיד (OH - ) הקבוצה נחשבת לנוקלאופיל חזק בכימיה אורגנית. הפניות: Martin. chaplin @ btinternet. com, M. C. (n d.). הידרוקסיד יונים. לאחזר דצמבר 28, 2016, מכאן הידרוקסיד יון: הגדרה & נוסחה - וידאו & שיעור תעתיק. (ד). מאחזר 28 דצמבר 2016, מכאן הידרוקסיד. (ד). מאחזר 28 דצמבר 2016, מכאן קבוצת הידרוקסי. (ד). 28 בדצמבר, 2016, מכאן הידרוקסייל קבוצה: הגדרה, מבנה & פורמולה. (ד). בתאריך 28 בדצמבר 2016, מכאן H. (2014). מהי קבוצת הידרוקסיל? פורסם ב -28 בדצמבר 2016, מכאן


