ההבדל בין לחץ חלקי ללחץ אדים
לחץ לחץ ולחץ אדים נפוצים במונחים מדעיים הנוגעים לכמות הלחץ המופעל על ידי רכיבי המערכת, אבל זהותם יכולה להיות מבלבלת לאחרים. יש הבחנה ברורה בין המונחים האלה, כולל השפעותיהם וזהותם. מאמר זה יפרט יותר על ההבדלים בין תנאים אלה. זה יכלול גם כמה דוגמאות כדי demystify את היישומים שלה.
- <->בואו נתחיל על ידי הדגשת המושג לחץ לפני שנוכל להתעמק בהבחנה בין אדי ולחץ חלקי. לחץ מוגדר מבחינה מדעית ככוח המופעל ליחידת יחידה על עצם או על חומר. זה יכול גם להיות מוגדר כוח המופעל על ידי חלקיקים מתנגשים זה על זה וזה נמדד לעתים קרובות באמצעות פסקל. במקרה של התנגשות של חלקיקים, משוואת הגז התיאוריה הקינטית של גזים משמש לחישוב הלחץ.
-> ->
מהו לחץ אדים?
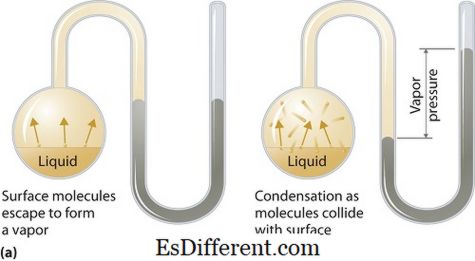
לחץ אדים יכול לחול על שלבים נוזליים או מוצקים. זה הלחץ המופעל על ידי אדי שיווי המשקל התרמודינמי שלה על מצב נוזלי או מוצק בטמפרטורה נתון במערכת סגורה כאשר הן אדי ואת הנוזל (מוצק) נמצאים במגע. לחץ זה נובע כתוצאה מאידוי, אשר מופעל על ידי חום מוגבר על מוצק או נוזלי. לכן הטמפרטורה משמשת כמדד של אידוי וזה ביחס ישר ללחץ אדים. משמעות הדבר היא שככל שהטמפרטורה גבוהה יותר, כך גדל לחץ האדים.
במהלך האידוי, מולקולות האוויר להימלט כתוצאה של אנרגיה קינטית גבוהה לאוויר במערכת סגורה. ואז, כאשר שיווי משקל, לחץ אדים מתעוררת בין אדי לצורה של תמצית נוזלים (מוצק). בפתרונות שבהם הכוחות הבין-מולקולריים חלשים יותר, לחץ האדים נוטה להיות יותר, ולהיפך, בפתרונות שבהם הכוחות הבין-מולקולריים חזקים יותר, לחץ האדים פחות.
לחץ האדים יכול להתרחש גם בתערובות האידיאליות כפי שהוסבר על ידי חוק ראול. היא קובעת כי לחץ האדים החלקי של רכיב מסוים בתערובת נוזלית או מוצקה שווה ללחץ האדים של אותו מרכיב מוכפל בחלק השומה שלו בתערובת זו בטמפרטורה נתונה. הדוגמה הבאה תמחיש זאת.
דוגמה 1
בהתחשב בתערובת אידיאלית של 0. 5 mol. אתנול ו 1. 5 מול. מתנול בלחץ אדי של 30KPa ו 52KPa, בהתאמה, לקבוע את הלחץ אדי חלקית של כל רכיב.
פתרון:
המספר הכולל של שומות הוא 1. 5mol + 0. 5mol = 2. 0mol. לפי חוק ראולט, לחץ האדים החלקי שווה ללחץ האדים המוכפל בשברי הטוחן של אותו רכיב.במקרה זה, P מתנול = 1. 5/2 * 52 = 39KPa ו- P אתנול = 0. 5/2 * 30 = 7. 5KPa.
כאשר יש לך לחצים אדי חלקי של הרכיבים בתערובת, אתה יכול לקבל את הלחץ הכולל אדי על ידי הוספת אותם יחד. בהקשר זה, 7. 5 + 39 נותן 46. 5KPa הלחץ הכולל אדי של תערובת של אתנול ומתנול פתרונות.
גורמים המשפיעים על לחץ אדים
זהות מולקולרית
כפי שכבר צוין לעיל, סוגי הכוחות המולקולריים קובעים את כמות לחץ האדים שיש להפעיל. אם הכוחות חזקים יותר, אז פחות לחץ אדים מתגלה, ואם חלש יותר, ואז לחץ אדים יותר עולה. לכן, הרכב הנוזל או מוצק ישפיע על לחץ אדי.
טמפרטורה
טמפרטורה גבוהה יותר מובילה ללחץ אדים גבוה משום שהיא מפעילה אנרגיה קינטית יותר לשבור את הכוחות המולקולריים, כך שהמולקולות יכולות להימלט מהר מהנוזל. כאשר לחץ אדים (לחץ אדים רווי) שווה ללחץ חיצוני (לחץ אטמוספרי) הנוזל יתחיל לרתיחה. טמפרטורה נמוכה יותר תביא ללחץ אדים נמוך ויידרש זמן עד שהנוזל ירתח.

חוק לחצים חלקיים של דלתון
מהו לחץ חלקי?
הרעיון של לחץ חלקי הוצע לראשונה על ידי המדען הנודע ג'ון דלטון. הוא הוליד את חוק הלחצים החלקיים שלו, הקובע כי הלחץ הכולל המופעל על ידי תערובת גזים אידיאלית שווה לסכום הלחצים החלקיים של גזים בודדים. למשל, מיכל מסוים מלא בגזי מימן, חנקן וחמצן, הלחץ הכולל, P סך הכל, יהיה שווה לסכום החמצן, החנקן והמימן. הלחץ החלקי של כל גז בתערובת זו מחושב על ידי הכפלת הלחץ הכולל על ידי חלק טוחנת של גז בודדים.
בקצרה, לחץ חלקי הוא הלחץ המופעל על ידי גז מסוים בתערובת, כאילו הוא פועל לבד במערכת. לכן אתה מתעלם גזים אחרים בעת קביעת הלחץ החלקי של גז בודדים. תיאוריה זו ניתן לאמת על ידי הזרקת, נאמר, 0. 6 6 מתוך 9 2 בתוך מיכל של 0 ליטר ב 230K ולאחר מכן הזרקת 0. 4 nm 2 במיכל זהה באותו גודל באותו טמפרטורה, ולאחר מכן בסופו של דבר לשלב את הגזים כדי למדוד את הלחץ הכולל; זה יהיה סכום של שני הגזים. זה מסביר בבירור את הלחץ החלקי של גז בודד בתערובת של גזים לא ריאקטיביים.
חישוב הלחץ החלקי
כדי לחשב את הלחץ החלקי הוא משב רוח מוחלט מאז חוק דלטון [1] מספק הוראות עבור זה. זה יהיה תלוי במידע טיפוסי שסופק. אם, למשל, הלחץ הכולל ניתן לתערובת של גז A ו- B, כמו גם את הלחץ של גז A, הלחץ החלקי של B יכול להיות מחושב באמצעות P סה"כ = + P B . השאר הוא מניפולציות אלגבריות. אבל במקרה שבו רק הלחץ הכולל של התערובת ניתנה, אתה יכול להשתמש בחלק טוחנת של גז B כדי לקבוע הוא לחץ חלקי.החלק הטוחני, מסומן על ידי X, ניתן למצוא על ידי חלוקת שומות של גז B על ידי סך חפרפרות של תערובת הגז. ואז כדי למצוא את הלחץ החלקי, תוכל להכפיל את החלק טוחנת, X, על ידי הלחץ הכולל. הדוגמה שלהלן מפרטת את זה.
דוגמה 2.
תערובת של חנקן וחמצן, עם 2. 5 שומות ו 1. 85 שומות, בהתאמה, מוזרק במיכל 0 0L עם הלחץ הכולל של 4atm; לחשב את הלחץ החלקי המופעל על ידי גז חמצן.
פתרון:
המספר הכולל של שומות בתערובת הוא 2. 5 + 1. 85 = 4. 35 שומות. אז השבר הטוחנת של חמצן, X o , יהיה 1. 85 שומות / 4. 35 שומות = 0. 425 שומות. הלחץ החלקי של חמצן יהיה 0. 425 * 4atm = 1. 7atm. את הלחץ החלקי של הגז הנותר ניתן לחשב בעקבות אותה גישה או ניתן לחשב באמצעות גז חמצן ואת הלחץ הכולל כפי שפרט החוק של דלתון של לחצים חלקיים כי הלחץ הכולל של גזים שאינם תגובתי שווה לסכום של הלחצים החלקיים.
ההבדל בין אדי ולחץ חלקי
מן ההסברים לעיל, ברור כי לחץ אדי ולחץ חלקי הם שני לחצים נפרדים. לחץ אדים חל על שלבים נוזליים ומוצקים בזמן שהלחץ החלקי חל על השלב הגזי. לחץ אדים מופעל בשלב המעבר לאחר הוספת חום מספיק לפתרון ובכך מוביל למולקולות שלו להימלט במערכת סגורה.
ההבדל העיקרי בין לחץ חלקי ללחץ אדים הוא שלחץ חלקי הוא הלחץ המופעל על ידי גז בודד בתערובת, כאילו היה בודד במערכת זו, ואילו לחץ האדים מתייחס ללחץ המופעל על ידי האדים שיווי משקל תרמודינמי עם מצב הנוזלים המצטבר או המוצק. הטבלה הבאה מציגה השוואה תמציתית של לחצים אלה.




