ההבדל בין 1 ל 2 אורביטלי | 1S לעומת 2s מסלול מסלול
ההבדל העיקרי - 1 לעומת 2 מסלולית
Atom הוא יחידת הקטן ביותר של החומר. במילים אחרות, כל החומר נעשה מאטומים. האטום מורכב מחלקיקים תת-אטומיים, בעיקר פרוטונים, אלקטרונים ונייטרונים. פרוטונים ואלקטרונים יוצרים את הגרעין, הנמצא במרכז האטום. אבל האלקטרונים ממוקמים באורביטלים (או רמות אנרגיה) הנמצאים מחוץ לגרעין האטום. חשוב גם לציין כי אורביטלים הם מושגים היפותטיים המשמשים כדי להסביר את המיקום הסביר ביותר של אטום. ישנם אורביטלים שונים המקיפים את הגרעין. יש גם תת-אורביטלים כגון s, p, d, f, וכו '. משנה של מסלולית היא כדורית בצורת כאשר נחשב מבנה 3D. למסלול זה יש את ההסתברות הגבוהה ביותר למציאת אלקטרון סביב הגרעין. תת-מסלולית ממוספרת שוב כמו 1s, 2s, 3s, וכו 'לפי רמות האנרגיה. ההבדל העיקרי בין 1s ו 2s מסלולית היא האנרגיה של כל מסלול. 1s מסלולית יש אנרגיה נמוכה יותר מאשר 2 מסלולית.
-> ->תוכן
1. סקירה והפרש מפתח
2. מה זה 1 ° מסלולית
3. מה זה 2S מסלולית
4. - השוואה בין-צדדית - 1 לעומת 2. סיכום
מהו 1s מסלול אורביטל?
1s מסלולית היא מסלולית הקרובה ביותר לגרעין. יש לה את האנרגיה הנמוכה ביותר בין אורביטלים אחרים. זה גם הצורה כדורית הקטן ביותר. לכן, הרדיוס של מסלול זה הוא קטן. לא יכול להיות רק 2 אלקטרונים במסלול של s. תצורת האלקטרון יכולה להיות כתובה 1s
1 , אם יש רק אלקטרון אחד במסלול זה. אבל אם יש זוג אלקטרונים, זה יכול להיות כתוב כמו 1s 2 . אז שני האלקטרונים במעבר של מסלול זה לכיוונים מנוגדים בגלל הדחייה המתרחשת בשל אותם מטענים חשמליים של שני האלקטרונים. כאשר יש אלקטרון לא מזוהה, זה נקרא פרמגנטי. זה בגלל זה יכול להימשך על ידי מגנט. אבל אם המסלול מלא ו זוג אלקטרונים נמצאים, האלקטרונים לא ניתן למשוך על ידי מגנט; זה ידוע בשם diamagnetic.
מסלול 2S גדול יותר מאשר 1s מסלולית. לפיכך, רדיוס שלה גדול יותר מזה של מסלול 1S. זהו מסלול הארון הבא אל הגרעין שאחרי 1 ° מסלולית. האנרגיה שלה גבוהה יותר מאשר 1s מסלולית, אבל נמוך יותר מאשר אורביטלים אחרים באטום. 2S ניתן גם למלא רק עם אחד או שניים אלקטרונים. אבל 2s מסלולית מלא אלקטרונים רק לאחר השלמת 1s מסלולית.זה נקרא עקרון Aufbau, אשר מציין את סדר מילוי האלקטרון לתוך תת אורביטלים.
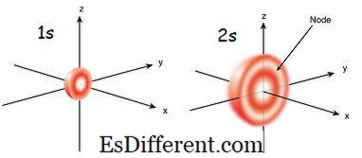
מה ההבדל בין 1 ל 2s מסלולית?
- diff מאמר ביניים לפני טבלה ->
1s לעומת 2S מסלולית
1s מסלולית היא הקרובה הקרובה ביותר לגרעין. |
|
| 2s מסלולית הוא השני הקרובה הקרובה ביותר לגרעין. | רמת אנרגיה |
| אנרגיה של 1 ° מסלולית גבוהה מזו של מסלול 2S. | |
| 2s יש אנרגיה נמוכה יחסית. | רדיוס אורביטל |
| רדיוס של 1 ° מסלולית קטנה יותר. | |
| הרדיוס של מסלול 2S הוא גדול יחסית. | גודל המסלול |
| מסלול 1S בעל צורת כדורית קטנה ביותר. | |
| 2s מסלולית גדולה יותר מאשר 1s מסלולית. | מילוי אלקטרון |
| אלקטרונים מלאים הראשון במסלול 1S. | |
| 2s מסלולית מלא רק לאחר השלמת אלקטרונים ב 1s מסלולית. | סיכום - 1s לעומת 2s מסלול אורביטלי |
אטום הוא מבנה תלת-ממדי המכיל גרעין במרכז מוקף אורביטלים בצורת שונים של רמות אנרגיה שונות. אורביטלים אלה מחולקים שוב תת-אורביטלים על פי הבדלים קלים של אנרגיה. אלקטרונים, המהווה חלקיק תת-אטומי עיקרי באטום, נמצאים ברמות האנרגיה הללו. 1 ו 2s תת אורביטלים קרובים לגרעין. ההבדל העיקרי בין 1 ל 2s אורביטלים הוא ההבדל ברמת האנרגיה שלהם, שהוא, 2s מסלולית היא רמת אנרגיה גבוהה יותר מאשר 1s מסלולית.
הפניה:
1. ליברטקסטים. "אטומים אורביטליים. "כימיה. Libretexts, 03 נובמבר 2015. אינטרנט. 26 מאי 2017.
2. אטומים, אלקטרונים ואורביטלים. נ., n. ד. אינטרנט. 26 מאי 2017.
תמונה באדיבות:
1. "S Orbitals" (croped) מאת CK-12 Foundation - קובץ: כימיה תיכונית. pdf, page 265 (CC BY-SA 3. 0) via Commons Wikimedia


