ההבדל בין תרכובות יוניות וקובאלנטיות | יונית מול תרכובות קוולנטיות
הבדלי מפתח - יוניים לעומת תרכובות קוולנטיות
ניתן להבחין בהבדלים רבים בין תרכובות יוניות וקובאלנטיות על בסיס המאפיינים המאקרוסקופיים שלהם, כגון מסיסות מים, מוליכות חשמלית, נקודות התכה ונקודות רתיחה. הסיבה העיקרית להבדלים אלה היא ההבדל בתבנית מליטה שלהם. לכן, שלהם דפוס מליטה יכול להיחשב ההבדל ההבדל העיקרי בין תרכובות יונית קוולנטית. (כאשר ההבדל בין אג"ח יוניות וקובאלנטיות) נוצר כאשר הקשר היוני נוצר, אלקטרונים נתמכים על ידי אלקטרונים מתכתיים ונתרמים על ידי מטאל שאינו מתכת. הם יוצרים קשר חזק בשל האטרקציה האלקטרוסטטית. קשרים קוולנטיים נוצרים בין שני לא מתכות. ב מליטה קוולנטית, שני אטומים או יותר לשתף אלקטרונים כדי לספק את הכלל octet. בדרך כלל, האג"ח היוניות חזקות יותר מקשרים קוולנטיים. זה מוביל את ההבדלים התכונות הפיזיות שלהם.
-> ->מה הם תרכובות יוניות?
קשרים יוניים נוצרים כאשר שני אטומים יש הבדל גדול ערכי electronegativity שלהם. בתהליך היווצרות האג"ח, הפסדי האלקטרו-אטום האלקטרוניים פחות אלקטרון (ים) ואטומים חשמלים יותר הם אלו שמקבלים אלקטרונים. לכן, מינים וכתוצאה מכך מינים מנוגדים יונים והם יוצרים קשר בשל המשיכה האלקטרוסטטית חזקה.
קשרים יוניים נוצרים בין מתכות ללא מתכות. באופן כללי, מתכות אין הרבה electronons valence בקליפה החיצונית; עם זאת, לא מתכות יש קרוב לשמונה אלקטרונים פגז הערכיות. לכן, שאינם מתכות נוטים לקבל אלקטרונים כדי לספק את הכלל octet.
דוגמה של תרכובת יונית >> + +
a NaCl

-> ->
מה הם תרכובות קוולנט?
תרכובות קוולנטיות נוצרות על ידי שיתוף אלקטרונים בין שני אטומים או יותר כדי לספק את "חוק אוקטט". סוג מליטה זה נמצא בדרך כלל בתרכובות שאינן מתכת, אטומים של אותו מתחם או אלמנטים סמוכים בטבלה המחזורית. שני אטומים שיש כמעט את אותם ערכי electronegativity אינם חילופי (לתרום / לקבל) אלקטרונים מן פגז הערכיות שלהם. במקום זאת, הם חולקים אלקטרונים כדי להשיג תצורה octet. דוגמאות לתרכובות קוולנטיות מתאן (CH 4
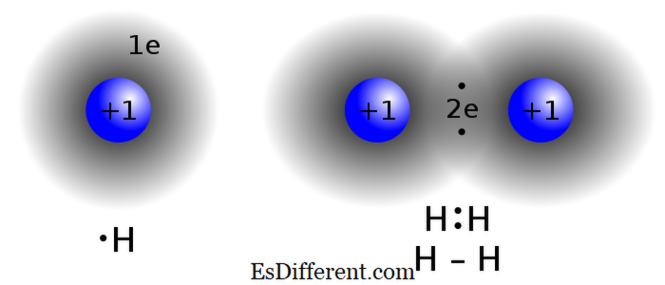
), פחמן חד חמצני (CO), יוד monobromide (IBR)
קוולנט מליטה
מה ההבדל בין יונית קוולנטית תרכובות?
הגדרת תרכובות יוניות ותרכובות קוולנטיות תרכובות יוניות:
תרכובת יונית היא תרכובת כימית של קטיונים ואניונים המוחזקים יחד על ידי קשרים יוניים במבנה הסריג. תרכובת קוולנטית:
תרכובת קוולנטית היא קשר כימי שנוצר על ידי שיתוף של אלקטרונים אחד או יותר, במיוחד זוגות של אלקטרונים, בין אטומים.
תכונות של יונית ותרכובות קוולנטיים
תכונות פיסיקליות
תרכובות יונית:
כל התרכובות היוניות קיימות כמו מוצקים בטמפרטורת החדר.
תרכובות יוניות יש מבנה גביש יציב. לכן, יש להם נקודות התכה ונקודות רתיחה גבוהות יותר. כוחות המשיכה בין יונים חיוביים ושליליים חזקים מאוד.| - diff מאמר בינוני לפני טבלה -> | מתחם יונית | מראה |
| נקודת התכה | NaCl - נתרן כלוריד | לבן גבישי מוצק |
| 801 ° C | KCl - אשלגן כלורי | לבן או חסר צבע גביש |
| 770 ° C MgCl 2 | - מגנזיום כלוריד | לבן או חסר צבע גבישי |
1412 ° C
תרכובות קוולנטיות: תרכובות קוולנטיות קיימות בכל שלוש הצורות; כמו מוצקים, נוזלים וגזים בטמפרטורת החדר.
נקודות ההיתוך וההרתיחה שלהן נמוכות יחסית לתרכובות היוניות.
| מתחם קוולנטי | מראה | נקודת התכה |
| HCl- מימן כלוריד | גז חסר צבע | -114. 2 ° C |
| CH 4 -Methane | גז חסר צבע | -182 ° C |
| CCl 4 - פחמן tetrachloride | נוזל חסר צבע < -23 ° C | מוליכות |
תרכובות יוניות:
תרכובות יוניות מוצקות אינן כוללות אלקטרונים חופשיים; לכן, הם לא לנהל חשמל בצורה מוצקה. אבל, כאשר תרכובות יוניות מומסות במים, הם עושים פתרון אשר מבצעת חשמל. במילים אחרות, פתרונות מימיים של תרכובות יוניות הם מוליכים חשמליים טובים. תרכובות קוולנטיות:
לא תרכובות קוולנטיות טהורות או צורות מומס במים לא לנהל חשמל. לכן, תרכובות קוולנטיות הם מוליכי חשמל עניים בכל השלבים. מסיסות
תרכובות יונית:
רוב המרכיבים היוניים הם מסיסים במים, אך הם מסיסים במיסים שאינם קוטביים. תרכובות קוולנטיות:
רוב התרכובות קוולנט הם מסיסים במיסים שאינם קוטביים, אבל לא במים. קשיות
תרכובות יונית:
מוצקים יוניים הם תרכובות קשות יותר ושבריריות. תרכובות קוולנטיות:
בדרך כלל, תרכובות קוולנטיות הן רכות יותר מוצקים יוניים. Image באדיבות: "מימן קוולנטי מימן" על ידי Jacek FH - עבודה משלו. (CC BY-SA 3. 0) באמצעות קומיקס "IonicBondingRH11" על ידי Rhannosh - בעבודת יד. (CC BY-SA 3. 0) באמצעות ויקישיתוף




