ההבדל בין מונטומי לדיאטומי | מונטומי לעומת דיאטומי
ההבדל בין מונטומי ו diatomic הוא בעיקר לגבי האטומים הנוכחי של המין. כפי שמציינים השמות, שני המונחים האלה מייצגים מצבים שונים של אסוציאציות אטומיות שבהן 'מונו' פירושו 'אחד' ו'די '' פירושו 'שניים'. "אם כך, פשוט, מונוטומי פירושו'אטום אחד
'ומשמעותו הדיאטומית של שני אטומים. " עם זאת, יכול להיות כל כך הרבה וריאציות שונות להגדרה הבסיסית הזו. -> -> מהו Monatomic? כאשר
אטום בודד קיים בכוחות עצמו(דבר שכמעט אינו קיים), אנו קוראים לו מונטומי. משמעות הדבר היא שהאלמנטים הם בצורתם הטהורה. הדוגמה המעשית היחידה שיכולה לבוא תחת הקטגוריה הזו תהיה הגזים האצילים הקיימים כמו אטומים משלהם, כאשר יש להם פגז החיצוני שלהם הושלמה עם octet של אלקטרונים. לפיכך, הם לא נראים לקבל או לתרום עוד אלקטרונים כדי להיות יציבים יותר. לכן, גזים אצילים יציבים בצורה מונטומית. כמה דוגמאות הן; ח - הליום, Ne - Neon, Ar - Argon, Xe - Xenon, Kr - Krypton, Rn - Radon.
מהו Diatomic?
כאשר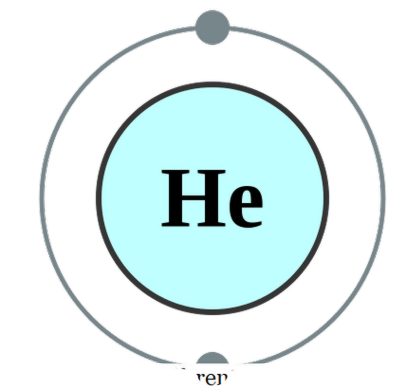
שני אטומים קשורים זה לזה
, אנו קוראים לזה דיאטומי. אטומים אלה יכולים להיות מאותו סוג או שונה. כאשר הם שני אטומים דומים, אנו קוראים לזה "דיאטומות homonuclear
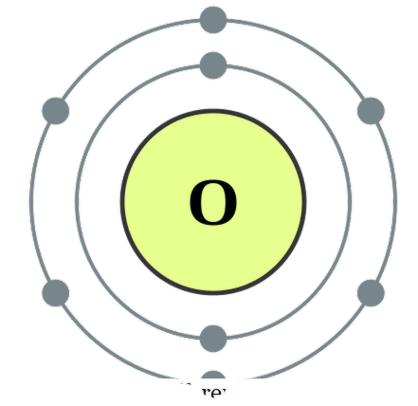
" ואם הם עשויים מסוגים שונים אנו מכנים אותו " diatoms heteronuclear '. דוגמאות עבור כמה diatoms homonuclear יהיה O2, N2, H2, וכו 'בעוד CO, NO, HCl, וכו' ניתן לתת כדוגמה עבור diatoms heteronuclear. חמצן Diatoms יכול להיחשב תרכובות כפי שהם יוצרים אסוציאציות אלה כדי להשיג יותר יציבות על ידי שיתוף אלקטרונים אחד עם השני, כך שני אטומים להשיג תצורה אלקטרונית גז אצילי. הם יכולים להתחבר דרך קשרים קוולנטיים על ידי חפיפה של אורביטלים אטומיים או אחר הם יכולים ליצור קשרים יוניים ביניהם אשר הוא כוח משיכה בין מין טעונה חיובי לבין מינים טעונים שלילית. דוגמאות לקשרים קוולנטיים בין diatoms כוללים CO, NO, וכו 'ו HCl יכול להיחשב מין עם אופי משיכה יונית. עם זאת, כמו כוח המשיכה בין H + ו Cl- הוא לא חזק מאוד, זה לא דוגמה טובה מאוד עבור קשרים יוניים כי הוא נושא מוגדר אחר. מה ההבדל בין מונטומי לדיאטומי? למינים מונטומיים יש אטום אחד ואילו למין הדיאטומי יש שני אטומים.
מינים מונטומיים הם בדרך כלל לא יציבים, אך מינים דיאטומיים יציבים בדרך כלל.
גזים אצילים הם רק מונטומיים ולא נמצאים בצורה דיאטומית.
קיימים קשרים כימיים בין מינים דיאטומיים, בעוד שאין קשרים בין מינים מונטומיים.
תמונות באדיבות:
תצורת אלקטרונים הליום על ידי פומבה (CC BY-SA 2. 0 בריטניה)
תצורת אלקטרונים של חמצן על ידי DePiep (CC BY-SA 3. 0)




