ההבדל בין Alkanes ו Alkene | Alkanes לעומת Alkene
ההבדל העיקרי - Alkanes לעומת Alkenes
Alkanes ו- Alkenes הם שני סוגים של משפחות פחמימנים המכילים פחמן ומימן במבנה המולקולרי שלהם. ההבדל העיקרי בין Alkanes ו Alkenes הוא המבנה הכימי שלהם; alkanes הם פחמימנים רוויים עם הנוסחה המולקולרית הכללית של C n H 2n + 2 ואלקנים הם קבוצת פחמימנים בלתי רוויים מאחר והם מכילים קשר כפול בין שני פחמן אטומים. יש להם את הנוסחה המולקולרית הכללית של C n H 2n.
-> ->מה הם Alkanes?
Alkanes מכיל רק קשרים בודדים בין אטומי פחמן ומימן (C-C ו- C-H). לכן, הם נקראים "hydroarbons רווי". על פי מודל הכלאה מסלולית, כל אטומי הפחמן באלקנס מכילים את הכלאה של 3 . הם יוצרים קשרים סיגמא עם אטומי מימן, ואת המולקולה שהתקבל יש את הגיאומטריה של טטרהדרון. Alkanes יכול להיות מחולק לשתי קבוצות על פי ההסדרים המולקולריים שלהם; אלקאנים אציקליות (ג n H 2n. 2 ) ו אלקאנים מחזורית (ג n H 2n ).

מה הם Alkenes?
Alkenes הם פחמימנים, המכילים פחמן פחמן (C = C) קשר כפול. "אולפינים" הוא השם הישן שהיה מתייחס למשפחת האלקן. החבר הקטן ביותר במשפחה זו הוא אתאן (C 2 H 4 ); הוא נקרא " olefian t גז (בלטינית: oleum ' פירושו' שמן '+ ' facere ' פירושו' לעשות ') בימים הראשונים. הסיבה לכך היא שהתגובה בין C 2 H 4 והכלור נותן C 2 H 2 Cl 2 שֶׁמֶן.

מה ההבדל בין אלקאנים לאלקנים?
מבנה כימי של אלקנים ואלקנים
Alkanes: Alkanes יש את הנוסחה המולקולרית הכללית C n H 2n + 2. מתאן (CH 4 ) הוא האלקן הקטן ביותר.
- diff מאמר לפני הטבלה ->| שם | נוסחה כימית | מבנה Acyclic |
| מתאן | CH 4 | CH 4 |
| אתאן C | 2 H 6 CH | 3 CH 3 פרופאן |
| C | 3 H 8 > | > 3 3 3 3 3 |
| 3 | > 3 CH 2 CH | 2 CH 3 פנטן C 5 H 12 |
| CH | 3 3 3 3 | 3 2 2 2 > H 14 CH 3 CH 2 |
| CH | 2 CH 2 CH | 2 CH 3 3 C 7 H 16 CH 3 CH 2 CH |
| 2 CH | 2 CH 2 CH | 2 CH 3 אוקטן C 8 H 18 CH 3 CH 3 CH 2 |
| CH | 2 CH 2 CH | 2 CH 3 CH 3 Alkenes: Alkenes יש את הנוסחה הכימית הכללית של C n H 2n .Alkenes נחשבים פחמימנים בלתי רוויים שכן הם אינם מכילים את המספר המקסימלי של אטומי מימן שיכול להיות בבעלות מולקולה פחמימנים. שם נוסחה כימית מבנה Ethene C 2 |
H 4 CH 2 = CH 2
| C | C | 3 |
| H | 6 CH 3 CH = CH | 2 בוטן C 4 |
| H | 9 9 | CH < 2 3 3 |
| CH | 3 CH = CHCH 3 960> 920> 920> 920> 920> 920> 920> 920> 920> 920> 920> 920> 2 -> <<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<< > | CH 2 CHCH 2 CH 2 CH 2 CH 3 |
| CH | 3 CH> CHCH 2 CH | 2 CH 3 CH 3 CH 2 CH > CHCH > > > > |
| 7 H 14 CH | = CHCH < 2 > 2 CH 2 CH 2 CH 3 CH 3 CH = CH < 2 > 2 CH 2 CH 2
CH 3 תכונות כימיות של אלקנים ואלקנים Alkanes: תגובה: Alkanes הם אינרטי כדי ריאגנטים כימיים רבים. הסיבה לכך היא פחמן פחמן (C-C) ו פחמן - מימן (C-H) אג"ח די חזקים מאז פחמן אטומי מימן יש כמעט את אותם ערכים electronegativity. לכן, קשה מאוד לשבור את הקשרים שלהם, אלא אם כן הם מחוממים לטמפרטורות גבוהות למדי. שרפה: Alkanes יכול בקלות לשרוף באוויר. התגובה בין Alkanes עם עודף חמצן נקרא "בעירה". בתגובה זו, alkanes להמיר פחמן דו חמצני (CO 2 ) ומים. |
|
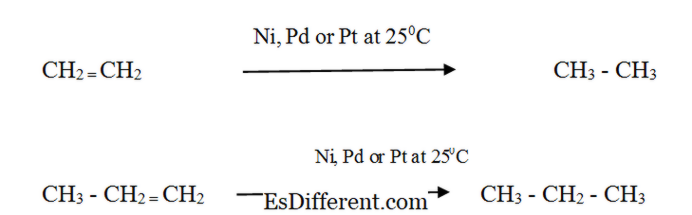
| C | n H 2n + (n + n / 2) O | 2 → n CO 2 + nH 2 C 4 H 10 + 13/2 O 2 → 4 CO 2 + 5H 2 O בוטאן חמצן פחמן דו חמצני מים תגובות הבעירה הן תגובות אקסותרמיות (הם נותנים חום). כתוצאה מכך, alkanes משמשים כמקור אנרגיה. Alkenes: תגובה: Alkenes להגיב עם מימן בנוכחות זרז מתכת מחולק דק כדי ליצור את האלקאן המקביל. שיעור התגובה הוא נמוך מאוד ללא זרז. הידרוגנציה קטליטי משמש בתעשיית המזון כדי להמיר שמנים צמחיים נוזליים לשומן מוצק למחצה בייצור מרגרינה ושומן בישול מוצק. תכונות פיסיקליות של אלקנים ואלקנים טפסים Alkanes: |
Alkanes קיימים כמו גזים, נוזלים ומוצקים. מתאן, אתאן, פרופאן ו בוטאן הם גזים בטמפרטורת החדר. המבנים הבלתי מסוערים של הקסאן, הפנטאן וההפטאן הם נוזלים. Alkanes שיש להם משקל מולקולרי גבוה הם מוצקים.
> >
4
4
10 הם גזים C
5 H 12 <<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<< Alkenes בעלי משקל מולקולרי נמוך יותר (C 2 H 4 toC 4 H 8) הם גזים בטמפרטורת החדר ובלחץ אטמוספרי.Alkenes בעל משקל מולקולרי גבוה יותר הם מוצקים. מסיסות: Alkanes: Alkanes לא להתמוסס במים. הם מומסים ממיסים אורגניים לא קוטביים או קוטביים חלשים. Alkenes: Alkenes הם מולקולות קוטביות יחסית עקב הקשר C = C; לכן, הם מסיסים במיסים שאינם קוטביים או ממיסים של קוטביות נמוכה. מים הם מולקולה קוטבית ואלקנים הם מסיסים במקצת במים. צפיפות: Alkanes: הצפיפויות של אלקאנים נמוכות יותר מהצפיפות של המים. ערך הצפיפות שלהם הוא כמעט 0. 7 גרם מ"ל -1,, בהתחשב בצפיפות של מים כמו 1. 0 גרם מ"ל -1
Alkenes:
הצפיפויות של Alkenes נמוכות יותר מהצפיפות של המים.
נקודות רותחות:
Alkanes:
נקודת הרתיחה של alkanes unbranched חלקה עולה ככל שמספר אטומי הפחמן והמשקל המולקולרי הולכים וגדלים. באופן כללי, alkanes מסועפת יש נקודות רתיחה נמוכות יותר לעומת alkanes unbranched, שיש את אותו מספר של אטומי פחמן.
Alkenes
: נקודות רותחים דומים alkanes המקביל עם וריאציה קטנה.
הפניות: CliffsNotes. (ד). מקור: יולי 06, 2016, מכאן.
תכונות פיסיקליות של אלקאנים. (2013). אחזור יולי 06, 2016, מכאן Zum Directory-modus. (ד). מקור חדשות לפי נושאים: יולי 06, 2016, מכאן תכונות כימיות של Alkanes: Wizznotes. חינם GCSE ו CXC: הדרכות, ניירות העבר חידונים. (ד). מקור: יולי 06, 2016, מכאן קוטביות. (ד). פורסם בתאריך 06 ביולי, 2016, מכאן רגעים דיפול. (2013). מקור חדשות לפי נושאים: יולי 06, 2016, מכאן איזומר מבנית. (ד). מקור: יולי 06, 2016, מכאן מבוא לאלקנים. (ד). <<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<< הדומיין הציבורי) via Commons Wikimedia